CHON: Los elementos de la química orgánica (segunda parte)
F. Alejandro Sánchez Flores
Instituto de Biotecnología, UNAM. Miembro de la Academia de Ciencias de Morelos
Retomando el tema de la entrega anterior (http://www.acmor.org.mx/?q=content/chon-los-elementos-de-la-qu%C3%ADmica-org%C3%A1nica-primera-parte), abordaremos el resto de los elementos que además del carbono, son los mas comunes en los organismos vivos. El hidrogeno (H), oxígeno (O) y nitrógeno (N) son de los elementos más abundantes en la Tierra, ocupando el primer, tercer y sexto lugar, correspondientemente. También destacan por tener el numero atómico mas bajo dentro de cada uno de sus grupos en la tabla periódica. Hablemos de cada uno de ellos y veamos como los encontramos en la naturaleza y en las moléculas orgánicas, sus ciclos y que importancia tienen.
“El que genera agua”
El hidrogeno (H) es bautizado por el químico francés Lavoisier, quien le llamó “productor de agua” debido al hecho de que se produce agua cuando el gas arde en el aire (del griego hidro = agua y gennao = producir). Sin embargo, la formación de hidrógeno elemental se registró por vez primera en el siglo XVI por el alquimista Paracelso (1493-1541), quien observó la formación de un gas producido por la acción de los ácidos sobre el hierro. No obstante, fue el químico inglés Henry Cavendish (1731-1810) quien aisló por primera vez a este elemento en su forma pura (H2) y lo distinguió de otros gases. El hidrógeno es el elemento más abundante en el universo, es el combustible nuclear que se consume en nuestro Sol y otras estrellas para producir energía. Aunque el 70% del universo se compone de hidrógeno, al ser muy poco masivo (número atómico pequeño), solamente constituye el 0.87% de nuestro planeta. A diferencia de los grandes planetas, tales como Saturno y Júpiter, la Tierra tiene un campo gravitacional muy débil para mantener las moléculas ligeras de los elementos gaseosos. No obstante, la mayor parte de este elemento se encuentra con mayor frecuencia combinado con el oxígeno formando agua. Debido a que el agua cubre cerca del 70% de la superficie terrestre hidrógeno se encuentra fácilmente disponible. Ahora bien, el hidrógeno también es un importante componente de un gran número de moléculas orgánicas como los hidrocarburos, celulosa, almidón, grasas, alcoholes, ácidos y amplia variedad de otras sustancias.
El hidrógeno es el único elemento que no es miembro de familia alguna de la tabla periódica. Debido a su configuración electrónica, generalmente se le coloca por encima del litio en la tabla periódica. Curiosamente, no es un metal alcalino debido a que no forma un ion positivo con facilidad, como lo hace cualquier metal alcalino. La energía de ionización del átomo de hidrógeno es de 1310 kJ/mol, mientras que la del litio es 517 kJ/mol. Esto quiere decir que se requiere de más del doble de energía para que se forme un ion que se combine con otros elementos, en comparación a los metales. El ion H+ es un simple protón aislado, el cual no se sabe que esté presente en ningún compuesto pero que si se libera en muchas reacciones biológicas como en la síntesis de la cadena de ADN o en el proceso de fotosíntesis en el cloroplasto o en la fosforilación oxidativa en la mitocondria. Su tamaño tan pequeño proporciona una fuerte atracción para los electrones, y puede atraer electrones de la materia que le rodea. Por esta razón, tiende a formar átomos de hidrogeno que se combinan para formar el gas H2.
El hidrógeno forma fuertes enlaces covalentes con muchos elementos, incluyendo al hidrogeno y oxígeno. La energía de disociación del enlace H—O es de 464 kJ/mol, el fuerte enlace H—O hace del hidrógeno un efectivo agente reductor para muchos óxidos de metal, por ejemplo, cuando el H2 pasa sobre Óxido de Cobre (CuO) calentado, se obtiene el metal cobre.
Los hidrocarburos son sustancias que constan de carbono e hidrógeno solamente. Como se había mencionado en la entrega pasada, pueden tener diferentes configuraciones (Figura 1). La clasificación de alifáticos y aromáticos tiene que ver con su configuración espacial y en particular en el caso de los alifáticos, se clasifican también dependiendo del tipo de enlace que se forme entre los átomos de carbono. Los hidrocarburos más simples son los alcanos (Figura 2) donde el octano es un hidrocarburo presente en las gasolinas y dependiendo de la cantidad de este, es la “potencia” que puede brindar una gasolina.
En la actualidad, la mayor parte del hidrógeno se obtiene en el proceso de la refinación del petróleo, en donde se rompen catalíticamente grandes cadenas de hidrocarburos en moléculas más pequeñas con la consecuente producción de H2 como producto de desecho.
“El que forma ácidos”
El nombre de oxigeno proviene de las raíces griegas oxys = ácido y gonos = productor, es decir “productor de ácidos”. A mediados del siglo XVII se identificó que el aire contenía un componente asociado con la ignición y con la respiración, pero no fue sino hasta 1774 que el oxígeno fue descubierto por Joseph Priestley quien publicó su trabajo antes que Carl Wilhelm Scheele quien también lo descubre de forma independiente en Upsala en 1773. De nuevo, Lavoisier es quien bautiza a este elemento en 1777.
El oxígeno juega un rol muy importante en la química orgánica y como se habló en la entrega pasada, forma parte de la mayoría de los compuestos que conforman a los seres vivos. En realidad, el oxígeno es el elemento más abundante tanto en la corteza terrestre como en el cuerpo humano. Constituye el 89% del agua por unidad de masa y el 20.9% por volumen de aire (23% por masa). El oxígeno molecular, O2, existe a la temperatura ambiente como un gas inodoro, incoloro e insípido. Es tan sólo ligeramente soluble en agua, pero su presencia en ella fue esencial para el inicio de la vida marina.
El enlace en el oxígeno es muy fuerte (la energía de disociación del enlace es de 495 kJ/mol). También forma fuertes enlaces con muchos otros elementos; en consecuencia, muchos compuestos que contienen oxígeno son termodinámicamente estables en comparación con el O2., puede acelerarse rápidamente para producir una reacción de explosiva violencia.
El ciclo del oxígeno
Al igual que el ciclo del carbono que se explicó en la entrega anterior, el ciclo del oxígeno (Figura 3) es vital para los organismos del planeta. Debido a que el número de átomos de oxigeno es fijo, conforme se toma del aire el O2 por medio de la respiración y otros procesos, este elemento necesita ser repuesto. Las principales fuentes inorgánicas del oxígeno además del O2 son el CO2 y el H2O.
Explicado de manera simple, cuando el O2 es convertido en CO2 en el proceso de respiración de cualquier ser vivo, se produce energía que le es útil a los organismos. Sin embargo, como también se había mencionado en la entrega anterior, para crear O2 a partir del CO2, se requiere de la energía solar, la cual es aprovechada por las algas marinas y plantas las cuales contribuyen a la vida sobre la Tierra realizando este reciclaje químico.
“El que genera salitre”
El nitrógeno tiene una etimologia curiosa, ya que tanto puede venir del latín nitrum o del griego nitro que históricamente se ha usado en forma vaga para referirse a diversos compuestos de sodio y de potasio que contienen nitrógeno, y de la raíz griega geno = generar; es decir, “que genera salitre”. Descubierto en 1772 por el botánico escocés Daniel Rutenford , quien lo encontró en su experimento en el cual encerraba a un ratón en un frasco sellado, el animal rápidamente consumía el componente provocándole la muerte. Cuando el “aire fijado” (CO2) en el recipiente era eliminado, permanecía en él “aire nocivo” siendo a su vez, incapaz de mantener la combustión ni la vida. Antoine Lavoisier se refería a él con el nombre azote que viene del griego ázoe y que significa “sin vida”, posiblemente lo llamó así por no ser apto para respirar.
El nitrógeno constituye el 78% del volumen atmosférico de nuestro planeta y se presenta como moléculas de N2. A pesar de que es un elemento para la vida, los compuestos de nitrógeno no son particularmente abundantes en la corteza terrestre. Los depósitos naturales más importantes de compuestos del nitrógeno, son los de KNO3 (salitre) en la India y de NaNO3 (salitre chileno) en Chile y otras regiones desérticas de Sudamérica. La molécula de N2 es muy poco reactiva, debido a la fuerza del triple enlace entre los átomos de nitrógeno. La energía de disociación del enlace N=N es de 951 kJ/mol, cerca del doble de la que se presenta en el O2. Cuando las sustancias arden en el aire, reaccionan normalmente con el O2, pero no con el N2. Es por esta razón que nuestra atmosfera es tan estable, de otra manera el oxígeno presente en el aire tendería a “incendiarse” o reaccionaría con gran facilidad. A pesar de la gran cantidad de nitrógeno atmosférico, este elemento es limitante: pocos organismos pueden asimilarlo en esta forma. Solo las plantas pueden captarlo eficientemente en forma de iones amonio (NH4+) o nitrato (NO3-).
El ciclo del nitrógeno en la naturaleza
El nitrógeno es un elemento esencial de los aminoácidos y los ácidos nucleicos, los cuales son los bloques básicos de las proteínas y ADN, correspondientemente. De todos los nutrientes minerales, el nitrógeno tiene el efecto mas importante en el crecimiento de las plantas. Por lo tanto, en la productividad primaria de los ecosistemas las plantas determinan la ruta crítica de este ciclo (Figura 4). Tambien es posible obtener compuestos nitrogenados de manera abiótica (sin involucrar organismos vivos), ya que los relámpagos en la atmosfera pueden ocasionan la formación del NO a partir de N2 y O2 en el aire.
Algunas plantas han establecido relaciones simbióticas con hongos y bacterias capaces de reducir el nitrógeno atmosférico a amonio, a cambio de lo cual reciben moléculas energéticas de la planta hospedera. El nitrógeno reducido es así incorporado a la cadena trófica. Quizás el caso más conocido sea el de las bacterias del género Rhizobium con las leguminosas, pero también existen asociaciones con bacterias del género Frankia e inclusive algunas cianobacterias. La bacteria Rhizobium etli y su relación con las raíces de frijol, fue el sujeto de estudio de muchos investigadores en Morelos donde se creo el Centro de Fijación del Nitrógeno de la UNAM (ahora es el Centro de Ciencias Genómicas) y dicha investigación fue pionera en el área de genómica bacteriana en México.
Los animales son incapaces de sintetizar los complejos compuestos nitrogenados que requieren para vivir, a partir de las simples sustancias que utilizan las plantas. En cambio, requieren de precursores mucho más complicados que están presentes en los alimentos. Aquellos compuestos de nitrógeno que el animal no necesita, se excretan como desechos nitrogenados.
Los cultivos a gran escala de leguminosas fijadoras de nitrógeno y la fijación industrial, han aumentado la cantidad de nitrógeno en la biosfera. De hecho, el aumento en el rendimiento de las cosechas se observa a partir de que se comenzaron a utilizar fertilizantes nitrogenados en el siglo XIX. Un efecto de esta intromisión en el ciclo del nitrógeno ha sido la creciente contaminación del agua. Mucho del nitrógeno fijado termina como nitratos en la tierra, compuestos que son altamente solubles en agua. Así, se lavan fácilmente de la tierra en aquellos sitios que se riegan en exceso, quedando únicamente una porción de los fertilizantes que se administran a las plantas. Una vez presentes en un lago, los nitratos estimulan el crecimiento de las plantas, provocando el rápido crecimiento de las algas. Esto aumenta el consumo de oxigeno que de por si es poco soluble en agua, provocando la muerte tanto de peces y demás organismos dependientes del oxígeno. El medio ambiente anaeróbico que resulta va a dar lugar a los desagradables olores que se asocian con los depósitos lacustres altamente contaminados.
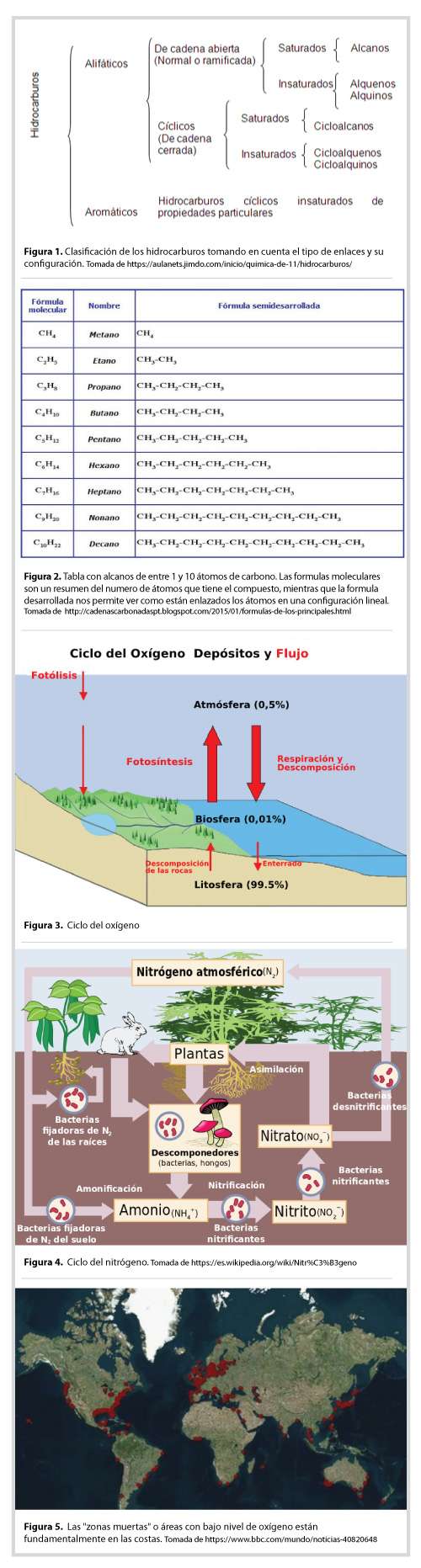
Esto también se observa en el mar como en las llamadas “zona muertas” que podemos encontrar en varios océanos del mundo (Figura 5). Por ejemplo, en la parte norte del Golfo de México, muy cerca de Nueva Orleans en el sureste de Estados Unidos, desemboca el río Misisipi (que cruza 10 estados de EE.UU.). Esta descarga lleva los desechos que generan las personas, así como compuestos nitrogenados provenientes del uso de fertilizantes y otros agentes químicos para la agricultura. Esto ha influido en la creación y expansión de una zona muerta donde la vida marina es inviable y que hace un par de años, alcanzo una superficie equivalente a la del El Salvador. De nuevo, este es un ejemplo donde la alteración de los ciclos de los elementos puede afectar de manera significativa la vida.
Finalmente, hemos revisado los elementos que forman el CHON que son los más característicos e importantes en los seres vivos. También se encuentran otros elementos como el fosforo, el azufre y otros metales de los cuales hablaremos en futuras entregas.
El 2019 ha sido propuesto por la Organización de las Naciones Unidas como el Año Internacional de la Tabla Periódica de los Elementos por lo que la Academia de Ciencias de Morelos ha decidido dedicarle una serie de artículos preparados por especialistas de diferentes disciplinas. Sirva este artículo para despertar su curiosidad y que nos permitan compartir con ustedes nuestro amor por los elementos y su máxima representación, la Tabla Periódica.
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.
Referencias:
Fuente: Academia de Ciencias de Morelos










.png)











No hay comentarios:
Publicar un comentario